 UDI一站式服务平台
UDI一站式服务平台
随着全球医疗器械监管体系不断完善,医疗器械唯一标识(UDI)的推广应用已成为行业重要趋势。7月10日,巴西国家卫生监督局(ANVISA)针对IV类医疗器械的UDI合规要求将正式生效,标志着巴西UDI实施进程迈入关键阶段。
2021年12月,ANVISA 发布了RDC 591/2021号决议,该决议规定了巴西医疗器械和IVD产品关于UDI的实施要求及执行截止日期(定制医疗器械和处于临床研究阶段的医疗器械除外)。该决议于2022年初生效,过渡期为三年。
2024年7月,巴西发布RDC 884/2024法规,修订RDC 591/2021关于UDI过渡期的规定,延长了不同风险等级医疗器械的UDI执行时限。根据新规,各风险等级医疗器械的UDI实施日期调整如下:
IV类医疗器械:2025年7月10日
III类医疗器械:2026年1月10日
II类医疗器械:2027年1月10日
I类医疗器械:2028年1月10日
需本体直接标识UDI的可重复使用医疗器械,其合规截止日期为对应风险等级实施日期后的两年。
为确保合规,企业需于2025年7月10日前,在IV类医疗器械产品标签及除运输容器外的所有上层包装上完成UDI标注,逾期或将面临市场准入限制。
ANVISA未来还将进一步扩大UDI实施范围(如III类器械),建议企业建立长效合规机制,以应对动态监管要求。
睿展数据UDI一站式服务平台
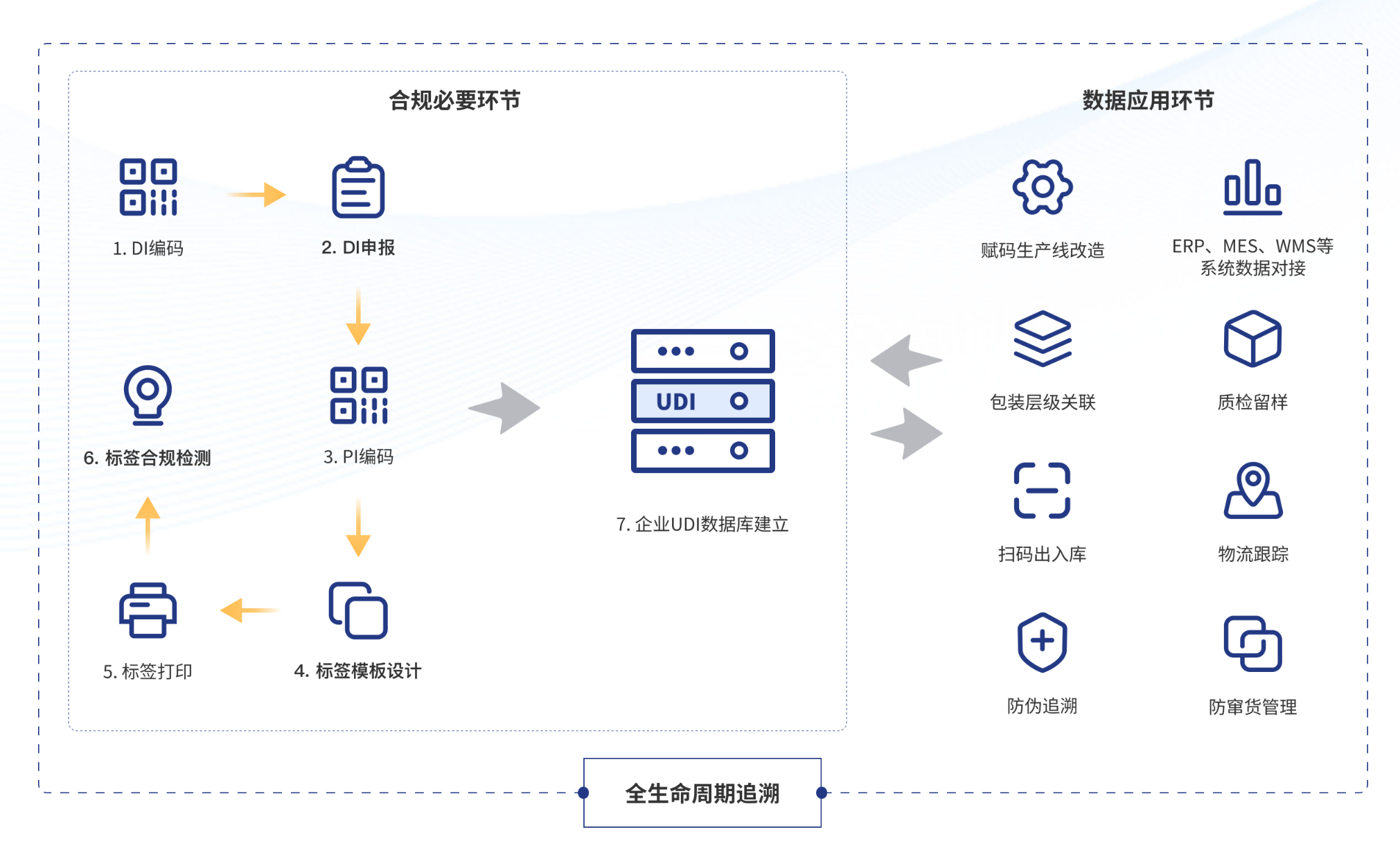
作为全球UDI合规服务专家,睿展数据为医疗器械企业提供一站式UDI解决方案,覆盖国内外法规咨询、编码申请、标签设计、产线赋码、质量检测及出入库管理、防伪追溯等全流程服务,帮助企业实现全球市场无缝准入。
更多UDI相关法规及实操性问题,欢迎随时联系我们!

公众号
研发中心
长沙高新区麓谷企业广场F3栋10楼
运营中心
长沙雨花区双塔国际广场B座14楼
南京办事处
南京栖霞区红枫科技园D11栋6楼
联系方式
400 900 3068
商务邮箱
market@rzdata.net
客服邮箱
support@rzdata.net


