 UDI一站式服务平台
UDI一站式服务平台
近日,美国食品药品监督管理局(FDA)发布了《组合产品的医疗器械唯一标识(UDI)要求》草案指南,首次明确含器械组件的组合产品适用UDI的具体情形。草案指南的出台将导致药械组合产品合规要求升级。本文将系统解读指南核心内容,帮助企业快速掌握UDI合规要点。

一、什么是组合产品?
根据21 CFR Part 3,组合产品分为三类:
1、单一实体组合产品
由两种或以上组成部分(如药品/器械、生物制品/器械等)物理混合形成的单一实体。
2、共同包装组合产品
两种或以上独立产品(如药品和器械)在同一包装内,作为单一单元销售,并需联合使用以达到预期用途。
3、交叉标注组合产品
独立生产的药品、器械或生物制品,通过标签说明需配套使用,但未物理组合或共同包装。其组合用途由各自产品的标签明确指示。
二、组合产品的UDI要求
1、单一实体组合产品
器械主导型(如药物洗脱支架、抗菌涂层导管):必须标注UDI。
药品/生物制品主导型(如预充注射器):若已有NDC(国家药品代码),则不需要也不应有UDI。
2、共同包装组合产品
器械主导型(如骨科手术冲洗套件):组合产品包装上需标注UDI,内部器械组件无需单独赋予UDI。
药品/生物制品主导型(如冻干粉+注射器套装):组合产品包装上正确带有NDC,无需UDI,内部器械组件需单独赋予UDI。
特殊情况:若组合产品中的器械组件已由原始供应商完成UDI标注,则组合产品制造商无需重复标注UDI。
3、交叉标记组合产品
因分开销售,各器械组件必须独立标注UDI。
三、可以豁免UDI的情形
1、如果组合产品的器械组成部分为I类GMP豁免器械,且用于同一用途,则无需UDI。
2、如果组合产品的器械组成部分是研究性器械,也不受UDI规则约束。
3、对于标签上已有UPC(通用商品代码)的I类器械,UPC可用作UDI。
4、具有NDC的单一实体组合产品无需UDI。
该指南虽以草案形式发布,但明确释放了FDA对组合产品UDI监管趋严的信号,企业需提前布局以避免被动。
睿展数据UDI一站式服务平台
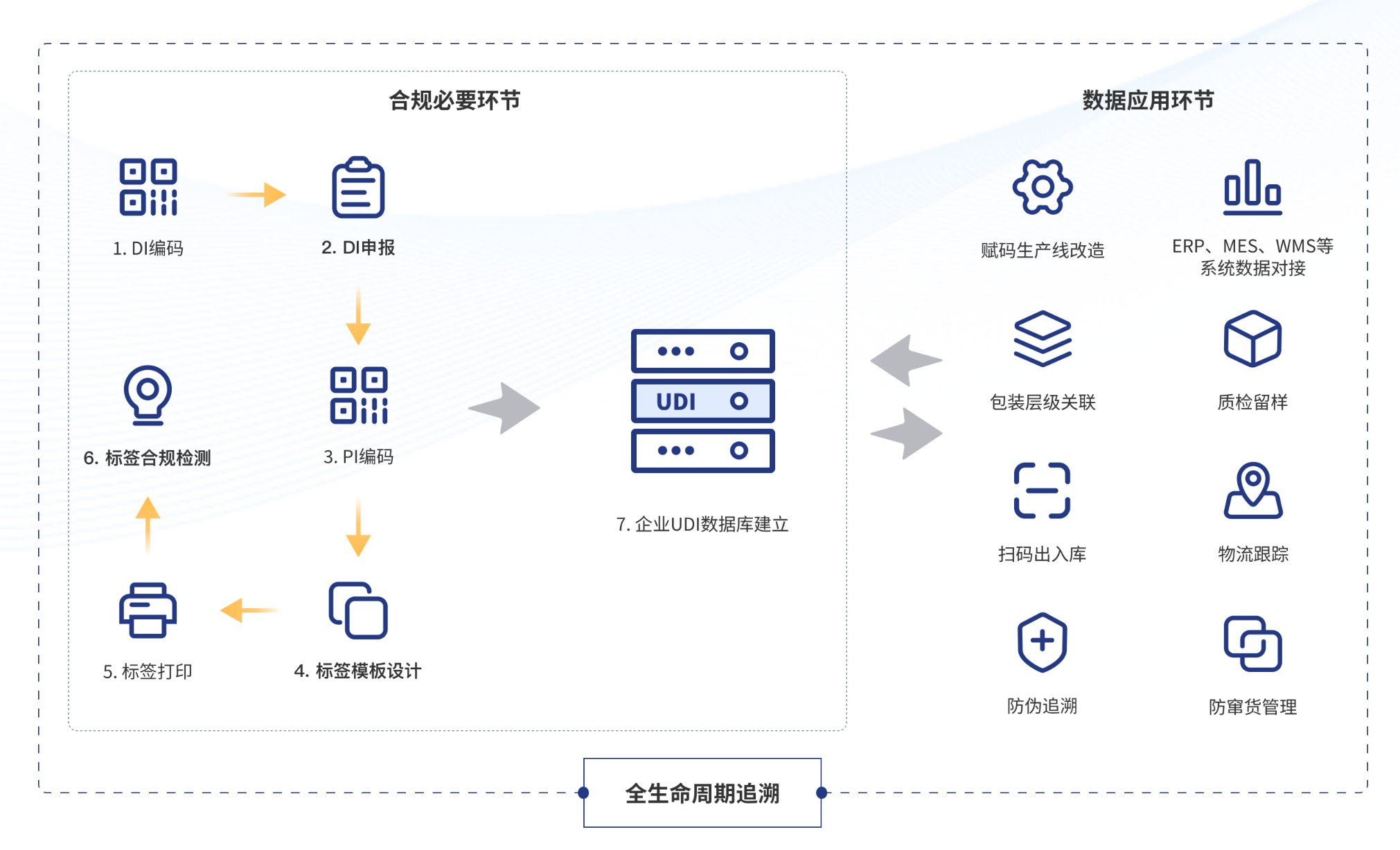
作为全球UDI合规服务专家,睿展数据为医疗器械企业提供一站式UDI解决方案,覆盖国内外法规咨询、编码申请、标签设计、产线赋码、质量检测及出入库管理、防伪追溯等全流程服务,可帮助企业轻松应对各类组合产品UDI复杂场景,实现全球市场无缝准入。
更多UDI相关法规及实操性问题,欢迎随时联系我们!

公众号
研发中心
长沙高新区麓谷企业广场F3栋10楼
运营中心
长沙雨花区双塔国际广场B座14楼
南京办事处
南京栖霞区红枫科技园D11栋6楼
联系方式
400 900 3068
商务邮箱
market@rzdata.net
客服邮箱
support@rzdata.net


