 UDI一站式服务平台
UDI一站式服务平台
随着科学技术的快速发展和市场需求的不断攀升,医疗器械行业规模持续扩大,海外市场正发展成为中国医疗器械企业群雄角逐的“第二阵地”。美国和欧盟作为我国医疗器械出口的两大市场,受到各器械厂商的高度关注。
为了帮助制造商及时了解欧美最新的医疗器械法规资讯,抓住合规先机,促进海外市场拓展,3月31日,飞天教育线上举办《2023年度医疗器械行业国际法规论坛》—医疗器械质量体系合规专场,睿展数据产品总监林磊应邀出席此次论坛。会议吸引来众多医疗器械相关从业人员参与,在线观看量达3000余人次。
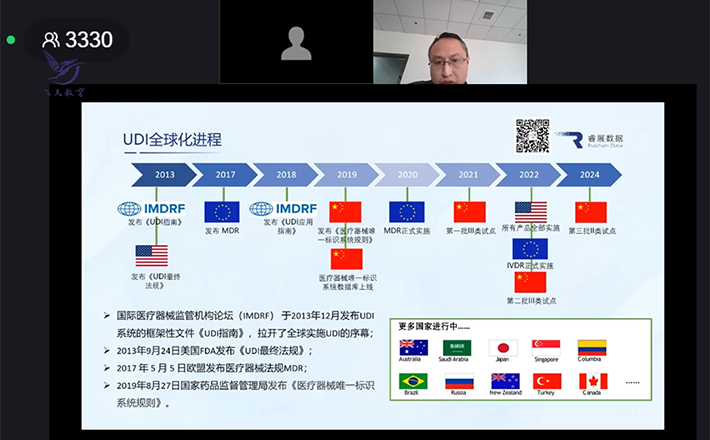
会上,林老师作了《美国FDA和欧盟MDR法规对于UDI的实施要求梳理和探讨》的主题讲座,从UDI全球进展及各地法规框架、中美欧UDI数据库注册流程梳理、中美欧发码机构对比等方面,向参会企业介绍了欧美医疗器械唯一标识政策下的合规要求,并将欧美的实施情况与国内进行横向对比,让大家能更全面、直观的了解UDI在各地区的实施差异。
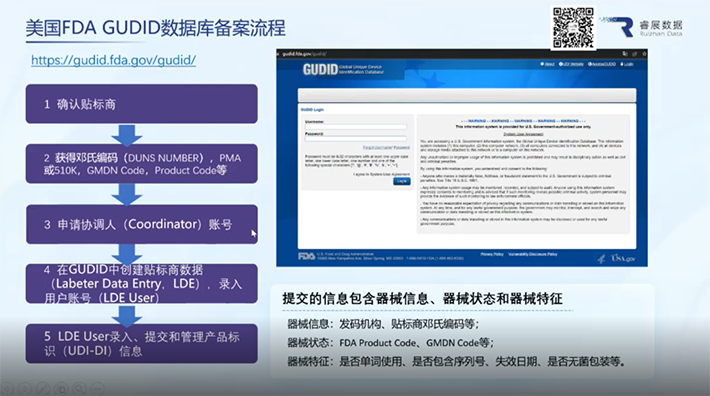
林老师根据企业在申请国外UDI的过程中存在的共性问题设置了相关课程内容,重点讲解了欧美医疗器械数据库备案/注册流程、基于GSI标准的UDI编码规则、UDI-DI分配规则、标签质量问题等,并分享了睿展数据在UDI方面的研究成果。

UDI作为全球医疗器械监管的先进手段,被越来越多的国家所采用,实施UDI是医疗器械企业的“必选题”。由于涉及到出口业务,部分企业需同时兼顾国内流通和海外流通两方面的合规要求,这对企业而言无疑是更高的挑战,因此选择优质的服务商来协助完成实施工作,效率会提高很多。
作为专业的UDI解决方案提供商,睿展数据于2021年开始协助企业推进UDI实施工作,通过不断的精进与创新,我们的技术与产品步入行业前列,现已帮助全国数百家企业完成了UDI的合规应用,其中不乏经营出口业务的企业。
睿展数据一直密切关注医疗器械唯一标识的实施进展及企业在实施过程中的需求,为医疗器械企业提供专业的UDI咨询指导与坚实的技术支撑是我们前进的不竭动力。接下来,睿展团队将继续深化服务水平和技术能力,推进UDI在医疗器械领域的深度应用。

公众号
研发中心
长沙高新区麓谷企业广场F3栋10楼
运营中心
长沙雨花区双塔国际广场B座14楼
南京办事处
南京栖霞区红枫科技园D11栋6楼
联系方式
400 900 3068
商务邮箱
market@rzdata.net
客服邮箱
support@rzdata.net


