 UDI一站式服务平台
UDI一站式服务平台
根据欧盟医疗器械新规,对于已纳入UDI实施范围的医疗器械在上市销售前,制造商都应为其赋予UDI,并体现在医疗器械标签、包装或器械本身。
目前,欧盟地区已完成植入式器械及Ⅲ类器械的UDI实施工作,今年5月26日,实施范围将扩展至Ⅱa、Ⅱb类器械和Ⅲ类-可重复使用器械、D级体外诊断试剂。计划出口欧盟且产品包含这4类器械的企业,需要抓紧实施UDI了。
▍欧盟UDI实施时间表

表1

表2
▍欧盟UDI实施流程
欧盟UDI实施的流程大致可分为以下5个步骤:
1、 申请并获取厂商代码
可通过中国物品编码中心的官网线上申请,也可以前往中国物品编码中心各分支机构线下申请。
2、 分配Basic UDI-DI
Basic UDI-DI是EUDAMED数据库中与设备相关的信息的主要访问键,用于连接具有相同预期用途、风险等级、基本设计和制造特征的器械。产品相关文档中也需要列明Basic UDI-DI,这些文件包括但不仅限于:CE证书、欧盟符合性声明、CE技术文件等。与UDI-DI不同的是,它没有任何数据载体,不会出现在产品及包装、标签上。
Basic UDI-DI的组成包括厂商识别代码(数字)+内部型号参考代码(字母数字)+校验码,字符长度不超过25位。
3、 分配UDI-DI和UDI-PI
UDI码包含两个部分:产品标识(DI)和生产标识(PI)。DI主要是用来区分产品的规格型号和包装层级,而PI是用来识别医疗器械产品生产过程中的各项关键数据,如生产日期、失效日期等。应确保DI长度为14位,如果不是,请在GTIN前面补零。
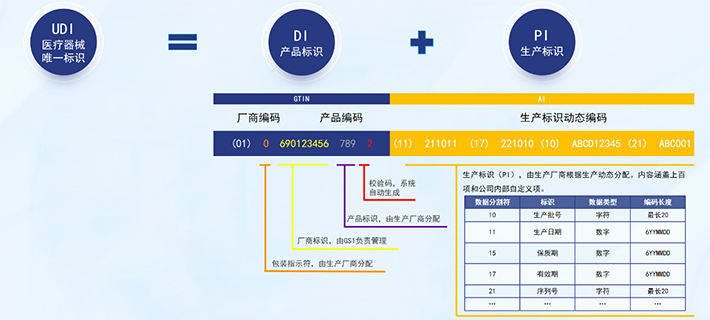
4、 注册欧盟医疗器械数据库(EUDAMED)
在EUDAMED注册为经济运营者,并获得制造商SRN,然后申请Eudamed信息录入员账号,录入Basic UDI和UDI-DI的数据信息。
5、 选择合适的UDI载体
根据器械类型和追溯所需信息,选择合适的UDI载体,如:一维码、二维码、RFID射频标签。三种数据载体各有优势,不过目前来说,选择二维码的企业会比较多。这里还有一点要注意的是,产品是否需要直接标记。5月26日以后,Ⅲ类-可重复使用器械应采用本体标识。
睿展数据UDI一站式服务平台,可为有出口需求的企业提供基于GS1标准的UDI编码及赋码服务,并给予注册、申报相关的咨询支撑。截至目前,我们已帮助近百家出口型医疗器械生产企业完成了UDI合规实施,成功开拓海外市场。
如果您也有出口产品需要赋UDI码,可以联系我们的平台老师进行咨询!

公众号
研发中心
长沙高新区麓谷企业广场F3栋10楼
运营中心
长沙雨花区双塔国际广场B座14楼
南京办事处
南京栖霞区红枫科技园D11栋6楼
联系方式
400 900 3068
商务邮箱
market@rzdata.net
客服邮箱
support@rzdata.net


