 UDI一站式服务平台
UDI一站式服务平台
近年来,美国食品药品监督管理局(FDA)一直在推进关于医疗器械UDI(唯一器械识别号)的监管法规,要求各类医疗器械标注UDI。
2022年7月25日,FDA发布UDI指南《医疗器械唯一标识(UDI):关于Ⅰ类和未分类器械的合规日期、直接标记和特定器械的全球唯一器械标识数据库要求的政策》。该文件将I类和未分类医疗器械执行UDI的时间由2022年9月24日延长至2022年12月8日。
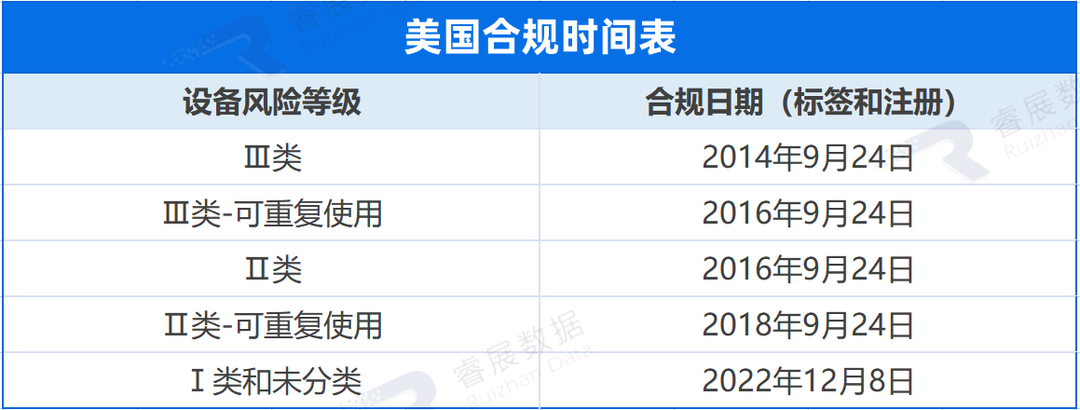
这也就意味着,12月8日以后所有进入美国市场的医疗器械产品均要向FDA的GUDID数据库提交产品数据,产品标签和包装上必须具备UDI。
距离12月8日,已经不足一个月了,你准备好了吗?
美国UDI合规实施步骤
1、组建团队
成立UDI实施小组,明确各有关部门的工作目标和任务,安排固定的人员登录FDA GUDID,对UDI数据进行日常维护更新。
2、获取邓白氏码
所有医疗器械品牌持有人必须要申请一个邓白氏码(D-U-N-S Number),该号码是一种实时动态的企业身份标识,相当于企业的“身份证”,邓白氏码是一个企业一个码。
3、确定UDI分配方案
出口美国的医疗器械,每个类别以及每个版本(针对软件)或者每个种类的每个规格都需要分配一个单独的UDI。同类型不同尺寸、颜色、材料、样式和包装大小的医疗器械,均需要分配不同的UDI。
4、获取GMDN代码
品牌持有人必须为提交给GUDID的每个医疗器械产品确定一个全球医疗设备命名(GMDN)首选术语代码。需要注意的是,GMDN代码申请周期可能会比较久,保险起见,企业要在合规日期之前申请好GMDN代码。
5、创建UDI-DI码
每个UDI都要有一个器械识别码(DI)。DI必须由FDA认可的机构颁发。目前,美国FDA认可的发码机构有3家:GS1、HIBCC、ICCBBA。其中,GS1是三家机构中唯一能在中国能找到的,且同时适用于中国、欧盟等国家和地区的发码机构。
6、创建GUDID账户并提交产品信息
企业需要申请一个GUDID账户,账户创建成功后,企业需要汇总产品关键信息并录入到GUDID数据库,包括产品的描述、DI码、品牌名称、版本号或型号、GMDN代码等等。数据库需要一周更新一次,公众可以查询到UDI数据以后,产品才能进行销售。
7、创建PI
除I类医疗器械外,所有医疗器械的UDI必须包含一个生产标识符(PI)。PI可包含批次或批号、序列号、有效期、生产日期等信息。
8、UDI系统维护
企业成功建立并执行UDI系统后,还需要对实施小组的人员进行培训,持续维护UDI质量体系,并更新GUDID的相关数据。
我们能提供什么?
睿展数据的UDI一站式服务平台,可为有出口需求的企业基于GS1标准创建UDI-DI码及UDI-PI码,并提供相关咨询服务。睿展数据已为多家出口型医疗器械企业完成UDI编码,助力企业高效完成UDI合规实施,顺利开拓海外市场。
如果您也有出口产品需要赋UDI,可以联系我们的平台老师进行咨询哦!


公众号
研发中心
长沙高新区麓谷企业广场F3栋10楼
运营中心
长沙雨花区双塔国际广场B座14楼
南京办事处
南京栖霞区红枫科技园D11栋6楼
联系方式
400 900 3068
商务邮箱
market@rzdata.net
客服邮箱
support@rzdata.net


