 UDI一站式服务平台
UDI一站式服务平台
我国UDI实施工作从2019年启动试点,2022年覆盖所有第三类器械,2024年开始过渡到第二类器械。短短几年,我国UDI体系建设取得了长足的发展,UDI与医保、医疗衔接应用,进一步推进了“三医联动”。
医疗器械生产企业是实施UDI的主体,也是UDI的源头。如何在政策规定时间内高质、高效完成UDI项目落地,以及通过UDI码实现对产品的数字化管理,驱动价值链的优化升级,是生产企业所要考虑的问题。
距离第三批实施时间,仅余两个多月。本文梳理并归纳了生产企业实施UDI的工作流程和重要事项,以供近期计划实施UDI的企业参考借鉴:
一、组建实施团队
1、组建UDI实施小组,制定UDI实施方案,明确小组成员的工作目标和任务以及各实施环节的时间节点。
2、搭建UDI知识库,组织学习培训,确保组内人员都能按照规范来执行工作。
二、选择发码机构
目前国内认可的发码机构有3家:中国物品编码中心(GS1)、中关村工信二维码技术研究院(MA)、阿里健康科技(中国)有限公司(AHM),其中GS1适用范围最广,全球通用。
选择GS1的编码体系,企业需要先申请厂商识别代码,申请方式分为线上及线下两种。线上通过登录中国物品编码中心网站进行申请;线下可以携带企业法人营业执照或营业执照副本及复印件,前往企业注册所在地编码分支机构窗口办理。
三、编码和申报
1、梳理产品信息,按照发码机构的标准为最小销售单元和更高级别的包装或医疗器械产品分配DI。企业还要考虑是否需要创建最小使用单元DI、产品本体标识等。DI编码完成后,在国家药监局医疗器械唯一标识数据库进行注册,并按规定进行DI申报。
2、根据行业规范,结合企业内部实际情况、客户需求确定PI编码组成。
四、确定UDI赋码方案
1、先选择合适的UDI载体,载体形式包含:一维码、二维码、射频标签(RFID)。载体的选择要考虑下游医院数据载体扫码接收的情况。
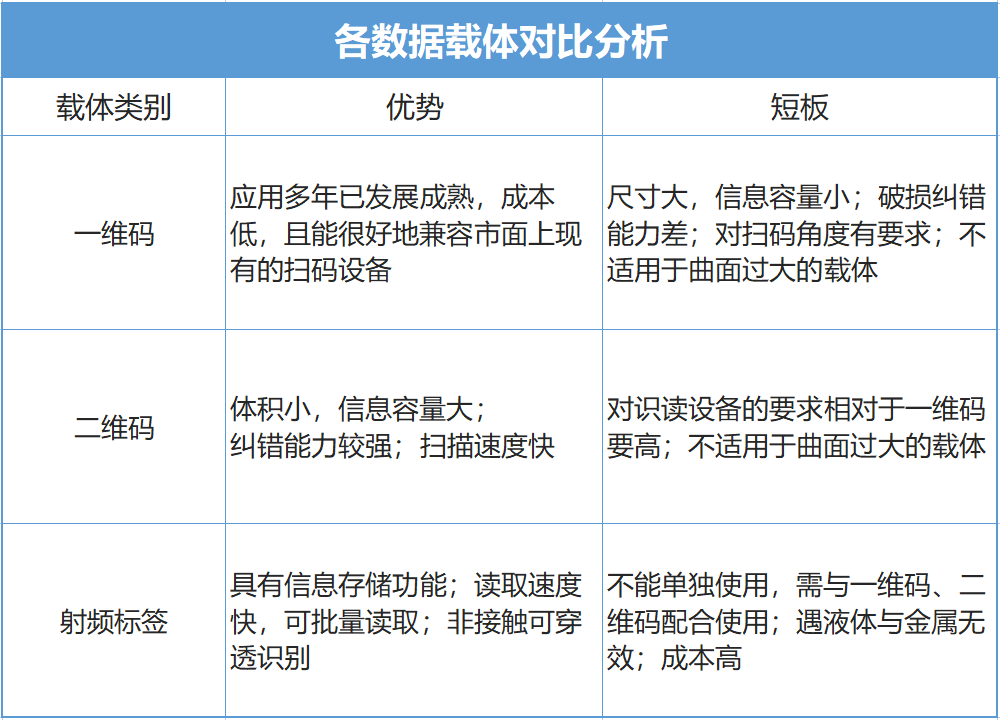
2、选定载体后设计UDI标签,标签应满足人工可识读、机器可识读两大基本原则,如空间有限或者使用受限,应当优先采用符合自动识别和数据采集技术的形式。
UDI一站式服务平台提供标签模板在线设计服务,内含丰富图标库、字体、组件,用户可便捷设计出各种样式的合规标签。系统直连UDI数据库,编码、申报、标签设计、打印形成一体闭环,保证后续标签打印的正确性。
3、选择赋码方式。常见的UDI赋码方式有热转印、UV喷码、热发泡喷码、激光打标等。不同的赋码方式,在适用材质、赋码效果、价格等方面存在差异,企业要根据产品的产量、包装(或产品本身)材质、使用场景、预算等情况进行选择。企业应确保UDI码在经营使用期间,牢固、清晰、可读。

4、设备采购及打样。根据选定的赋码方式采购对应的硬件设备。在正式批量赋码前,应预先编码并进行样品测试,确保最终赋码效果。
五、标签质量检测
标签质检是保证UDI码合规的最后一道防线。不符合质量要求的的UDI标签可能会造成产品返厂、延期交货等不良后果,因此产品出厂前的标签检测对企业而言必不可少。
企业可以将标签送至发码机构或第三方检测机构进行检测,也可以自行购置设备来检测,自检灵活度更高。睿展数据UDI一站式服务平台为企业提供PDA(人工检测)、智能UDI标签质量检测仪(自动检测)两种方案,满足不同企业的检测需要。
六、建立UDI数据库
UDI数据库用于存储和管理产品UDI数据及相关信息,是企业数据的保险箱和中控台,也是实现产品全生命周期追溯的基础。企业可以自建UDI数据库管理系统,不过开发周期较长,成本较高;也可以采用第三方的系统。
七、UDI升级应用
新版《医疗器械经营质量管理规范》中明确提出,鼓励企业数字化、智能化、绿色化发展,提升医疗器械供应链效率与质量安全。作为上游的生产企业,如果条件允许,可以提早布局UDI数字化建设,实现UDI系统与下游业务的贯通。
合规,是UDI实施的基础目标,而非终点。企业可以通过探索合规之外的UDI升级应用,来激发UDI的最大价值。UDI带码出入库、层级关联、防伪防窜货、全生命周期追溯等应用可以帮助企业提升内部管理效能和客户满意度,让企业发展更上一层楼。
八、协调解决下游客户问题
产品带码上市后,可能会出现下游客户无法识读解析UDI码的情形,致使产品不能正常入库销售。遇到这种情况,生产企业应该及时核实处理,促进UDI在经营、使用环节的应用。
第三批实施的时间期限已近在咫尺,时间较紧迫,如果您想尽快实现UDI合规或是实施过程中遇到了任何问题,都可以联系我们,UDI一站式服务平台的老师会为您提供完备的解决方案。

公众号
研发中心
长沙高新区麓谷企业广场F3栋10楼
运营中心
长沙雨花区双塔国际广场B座14楼
南京办事处
南京栖霞区红枫科技园D11栋6楼
联系方式
400 900 3068
商务邮箱
market@rzdata.net
客服邮箱
support@rzdata.net


