 UDI一站式服务平台
UDI一站式服务平台
为规范医疗器械唯一标识(UDI)系统建设,加强医疗器械全生命周期管理,国家药品监督管理局制定发布了《医疗器械唯一标识系统规则》,并于2019年10月1日起正式施行。
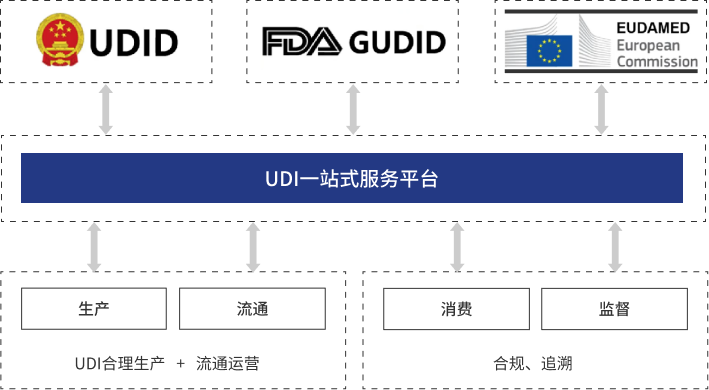
二、UDI一站式服务平台
登录睿展数据UDI一站式服务平台后,在后台单个DI自动编码或填写表格批量DI自动编码,导入申报信息后,直接点击一键申报,自动完成DI申报,并且平台提供专家一对一咨询指导。平台主要优势如下:
合规
直接对接国家药监局数据库,DI编码一键申报、同步、更新、下载;申报数据经平台自动合规验证;内置DI自动化算法工具,合规生成。
安全共享
提供安全存储数据库;内部系统之间的数据共享应用;支持监管部门的备查;支持行业下游数据共享。
简便
申报规则无缝嵌入平台填报;DI一键申报到国家药监局数据库;无需多平台填报;一次填报,全平台无缝集成使用;
高性能
DI、PI数量无使用上限;数据存储容量无上限;DI一键申报到国家药监局数据库;编码能力可满足千万级日产量企业;
智能
支持自定义编码规则;高效无误的千万级编码;自动关联溯源信息;
扫码立即申请一对一咨询

申报完之后,企业可以通过以下方式进行查询:

GS1扫码查询示例图
三、睿展数据·UDI一站式服务平台小程序
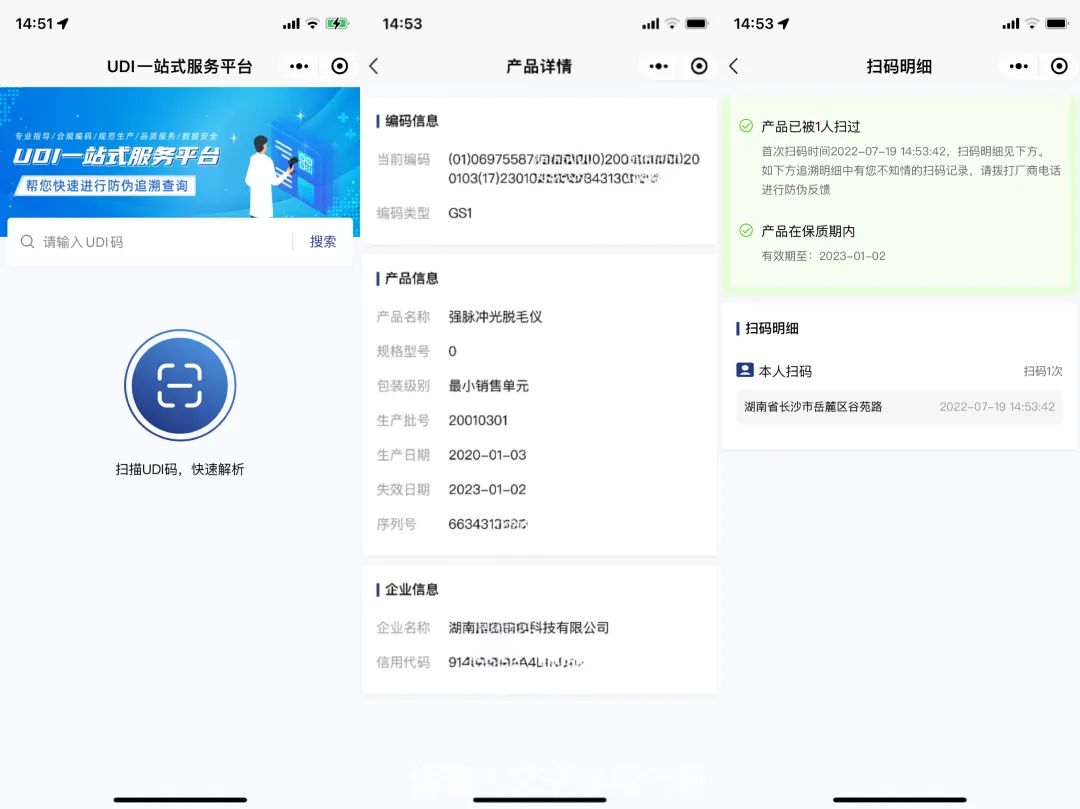
扫码后可查询产品相关信息及防伪追溯信息
医疗器械企业给产品赋予合规、合理的UDI编码后,掌握好申报和查询的方式,切实履行相关义务,各UDI应用方才能正确使用UDI编码,切实提升医疗器械识别的准确性,提升医疗器械管理的精细化程度,优化医疗器械供应链效率。


公众号
研发中心
长沙高新区麓谷企业广场F3栋10楼
运营中心
长沙雨花区双塔国际广场B座14楼
南京办事处
南京栖霞区红枫科技园D11栋6楼
联系方式
400 900 3068
商务邮箱
market@rzdata.net
客服邮箱
support@rzdata.net


