 UDI一站式服务平台
UDI一站式服务平台
为贯彻科学监管理念、进一步推进智慧监管和医疗器械高质量发展,助推我国医疗器械唯一标识(UDI)实施,了解UDI企业实施规范流程指南。睿展数据生态产品总监林磊老师,于7月11日20:00-21:00进行了线上相关知识讲解。
一、医疗器械唯一标识(UDI)基本概念介绍
二、UDI实施步骤建议及应用指南
林老师围绕企业实施UDI的规范流程——UDI基本概念、UDI相关标准及国家政策、生产企业实施UDI的困难、UDI实施流程指南(发码机构选择,编码规则制定,UDI载体选择,条码质量要求,标签设计打印等)、企业UDI数据库构建及应用等方面进行沟通交流。培训过程中,学员与老师积极参与,林老师深入浅出的讲解让学员对UDI的实施流程有了非常全面的认识。以下是精彩内容分享:
1.实施步骤

2.发码机构的选择
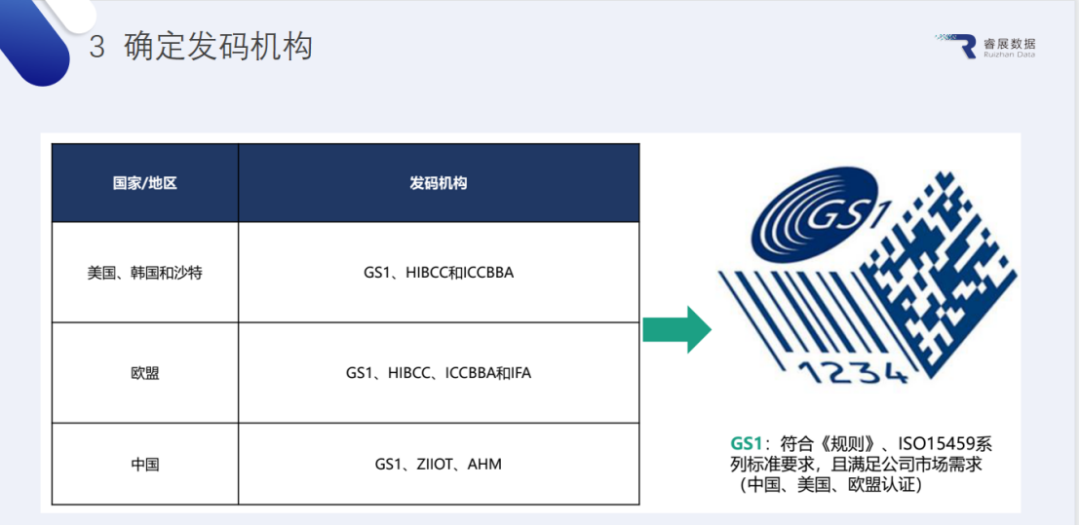
各国都有多家发码机构,其中GS1是符合国内规范、ISO15459系列标准要求,且满足全球市场要求的标准。睿展数据也是中国物品编码中心官方推荐的GS1标准服务商。
3.在线标签模板

《医疗器械唯一标识系统规则》和GS1的规范,在产品预留空间足够的情况下,给医疗企业生产企业保留了自由发挥空间,UDI一站式服务平台提供在线标签模板设计功能,能够自定义标签模板,满足了个性化需求。
4.质量等级检测
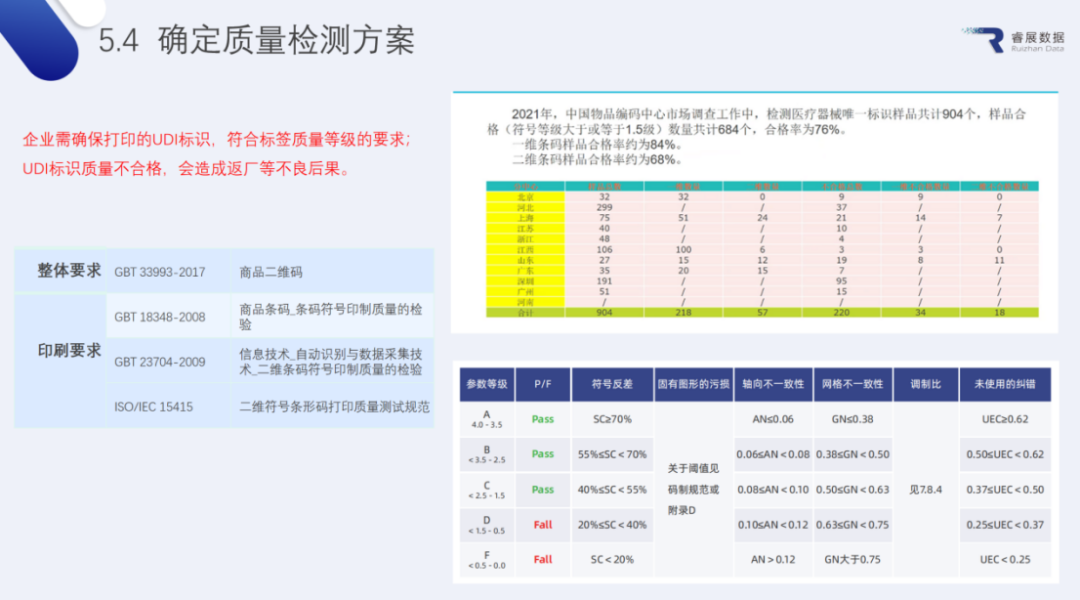
如果产品上的UDI标识不可识读,企业遭受投诉等不良影响范围就会更广,除了在设计、赋码过程中要保障,更重要的是在于检测。UDI一站式服务平台提供标签可识读性以及等级检测全套服务,确保企业打印的UDI标签能正常可识读,达到质量等级要求。

更多合规问题,可扫码一对一咨询:

联系人:张老师

公众号
研发中心
长沙高新区麓谷企业广场F3栋10楼
运营中心
长沙雨花区双塔国际广场B座14楼
南京办事处
南京栖霞区红枫科技园D11栋6楼
联系方式
400 900 3068
商务邮箱
market@rzdata.net
客服邮箱
support@rzdata.net


