
医疗器械唯一标识(UDI)是医疗器械产品的唯一“电子身份证”。建立UDI系统,可实现生产、经营、使用各环节的透明化、可视化,有利于进一步从源头建立起医疗器械全生命周期的监管链条,提升产品的可追溯性,降低医疗风险。UDI 是解决医疗器械全球监管问题的通用语言,其重要性已被越来越多的国家所认识,全球UDI 实施步伐正不断迈进。
目前,全球范围内施行医疗器械唯一标识制度的国家(地区)有:中国、美国、欧盟、巴西、加拿大、澳大利亚、中国台湾、新加坡、日本、韩国、印度、沙特阿拉伯。
本期,睿展数据整理了以上12个国家和地区的UDI 实施进度,供大家参考。UDI时间表和截止日期因市场和产品而异,一些国家(地区)已多次进行修订,这些日期可能会随着参与国(地区)调整其计划而改变,我们将继续更新相关信息。
中国
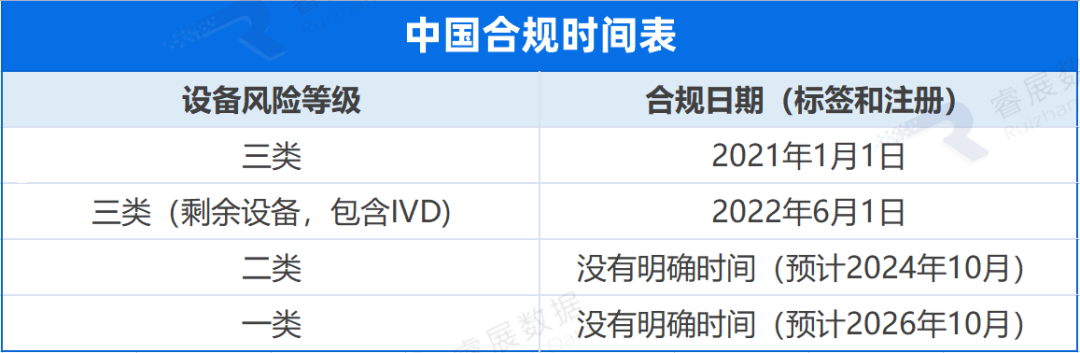
美国
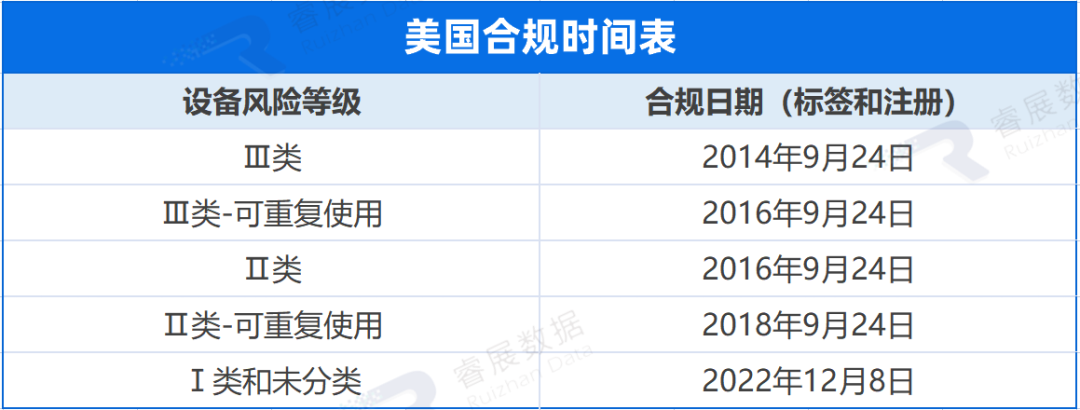
欧盟
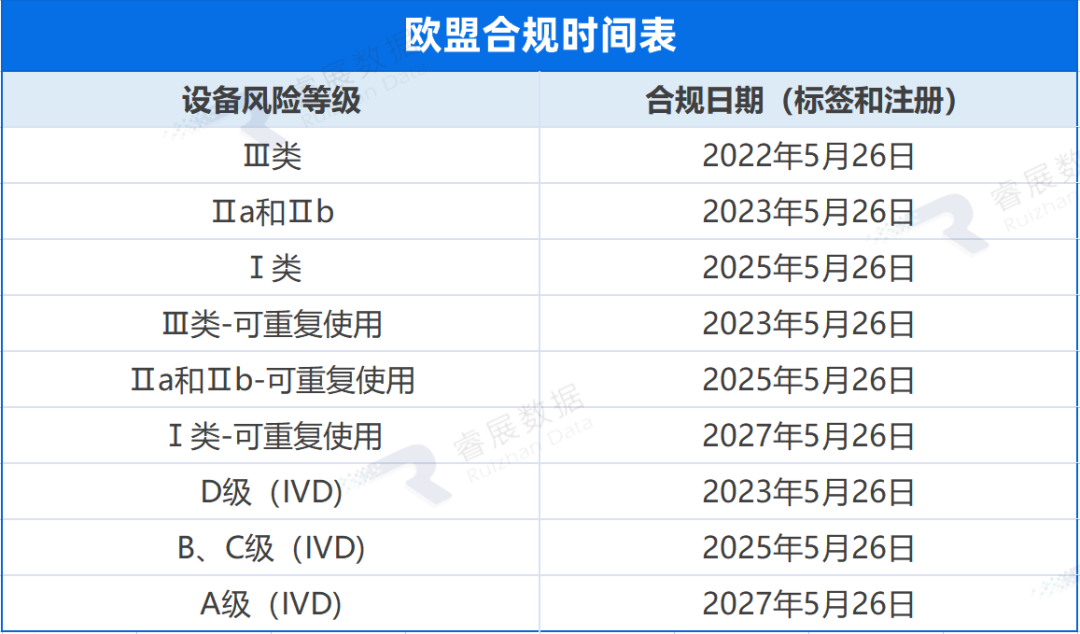
巴西
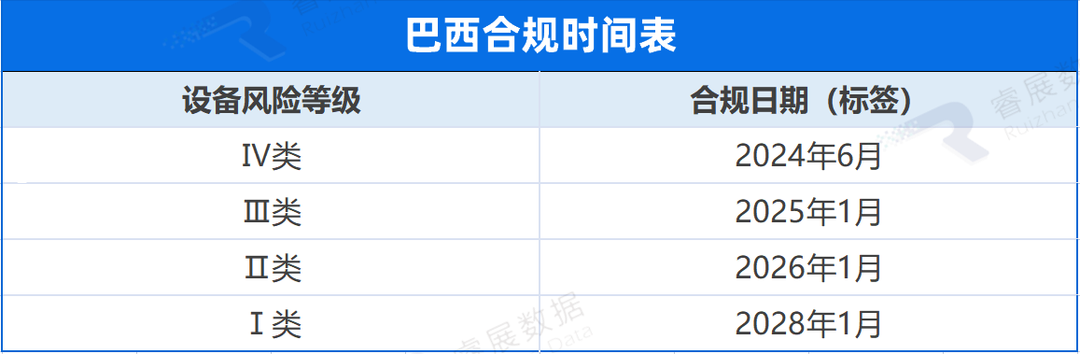
加拿大
加拿大卫生部已经提出了一个 UDI 框架,框架紧密地基于IMDRF发布的 UDI 指南。目前的提案要求所有设备都贴上 UDI 标签,I类低风险设备除外。加拿大卫生部打算开发一个 UDI 数据库,或者修改现有的医疗设备活动许可证列表数据库(MDALL)以容纳 UDI 数据。预计与大多数国家一样,加拿大将根据需要添加少量额外的 UDI 数据属性。
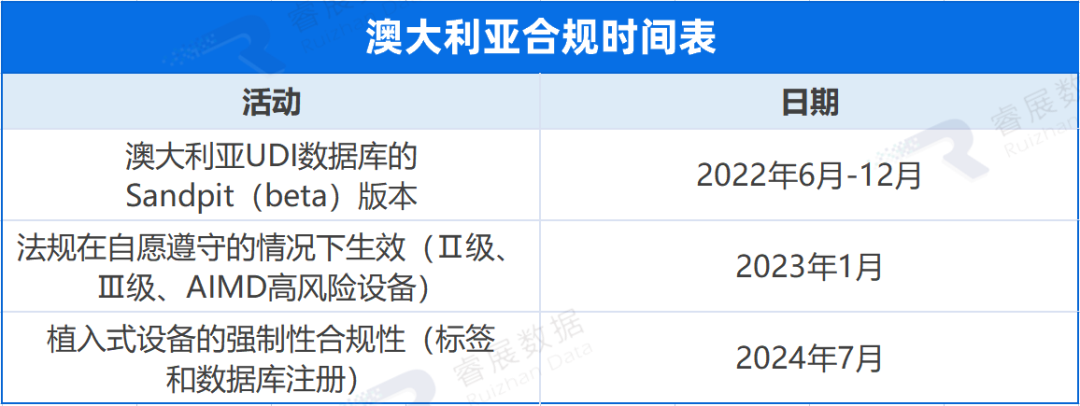
澳大利亚
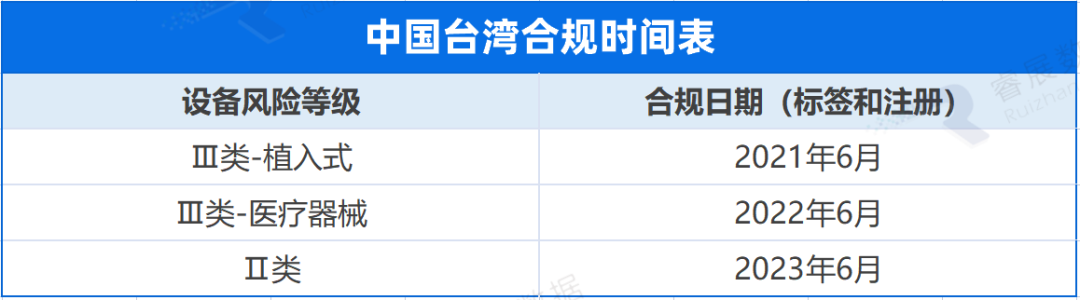
中国台湾
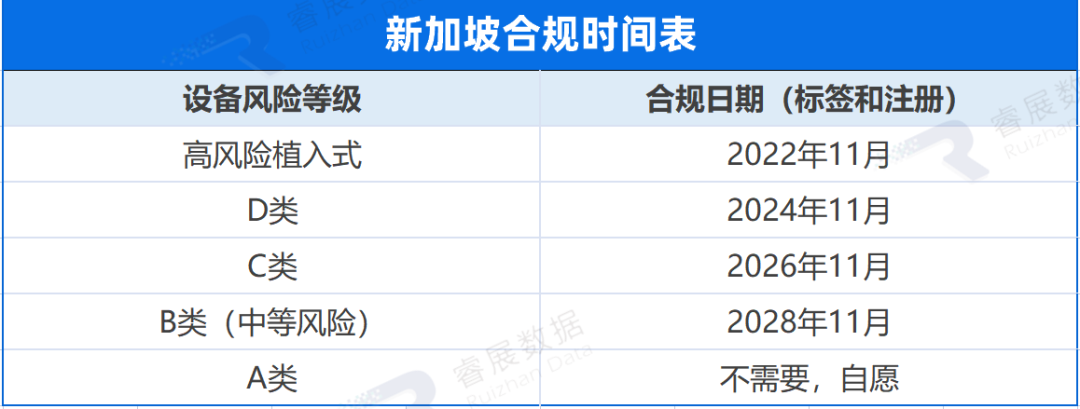
新加坡
日本
2008年,日本厚生劳动省(MHLW)发布了“医疗器械上放置标准代码(条形码标记)的指南”。这在鼓励器械包装上使用条形码方面取得了成功,但在器械上的直接标记仍然非常有限。
2016年,JFMDA(日本医疗器械协会联合会)出版了《医疗器械UDI操作手册》,进一步鼓励在特定类型的医疗器械上直接标记条形码。
2019年《药品和医疗器械法》被称为PMD法案,其中包括医疗器械包装的UDI标签要求。经过修订,该法案自2022年12月起生效,根据器械类型逐步实施,医疗器械的即时容器、包装材料、零售包装要求使用基于国际标准的条形码标签。具体地说,预计条形码将以病人使用单位显示在每一个药品和医疗器械上。此外,应推广在临床环境下使用条形码标签的安全措施,以及由MAHs在数据库中注册生产信息。
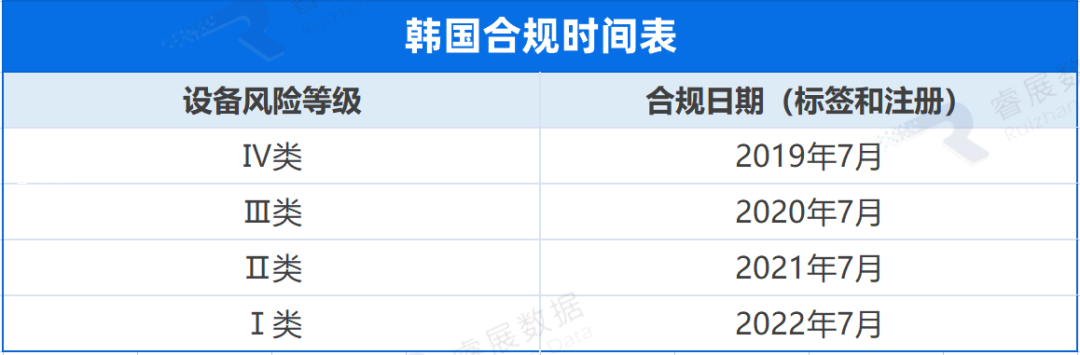
韩国
印度
2021年底,印度卫生和家庭福利部推迟了UDI在印度的实施要求,新的截止日期尚未出台。之前2017年《医疗器械规则》第46条规定,要求在2022年1月1日之前,对批准在印度制造、销售、分销或进口的医疗器械贴上UDI标签。关于如何在设备上显示UDI的详细信息以及UDI需要包含哪些特定信息,目前尚未发布。
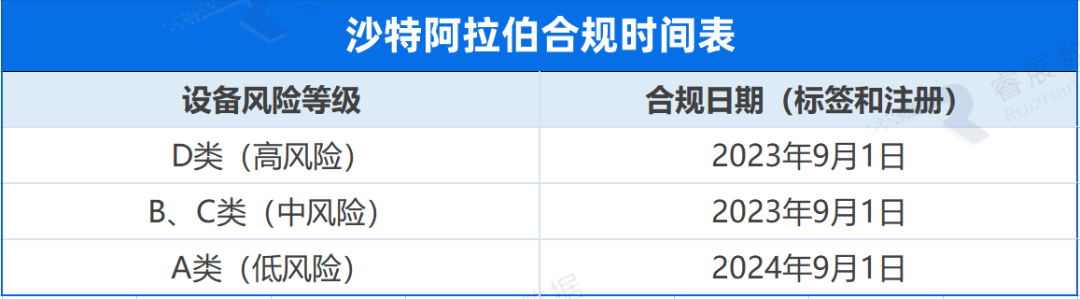
沙特阿拉伯
当前,UDI实施全球化的趋势已不可逆转,国内推行医疗器械唯一标识应用的发展态势也如火如荼。对此,睿展数据以UDI一站式服务平台为载体,以数字技术为驱动,专注服务与赋能医疗器械企业,助力加快国家UDI全面实施步伐,推动医疗器械产业转型升级,实现高质量发展。
想要了解更多UDI实施相关资讯,可扫描下方二维码与张老师联系,或拨打专家热线:400-900-3068。


UDI 一站式服务平台微信公众号
研发中心
长沙高新区麓谷企业广场F3栋10楼
运营中心
长沙雨花区双塔国际广场B座14楼
南京办事处
南京栖霞区红枫科技园D11栋6楼
联系方式
400 900 3068
商务邮箱
market@rzdata.net
客服邮箱
support@rzdata.net



